刘斌,孙静的文章“Injectable and NIR-responsive DNA-inorganic Hybrid Hydrogel with Outstanding Photo-Thermal Therapy”在Adv. Mater.杂志上发表。
背景
手术切除是恶性肿瘤的主要治疗方法,但这种方法对正常器官和组织会造成原发性损伤,并存在复发、术后耐药性等问题。近红外(NIR)光响应性材料侵入性最小且穿透深度大,它们在癌症光热疗法(PTT)领域中非常热门。金纳米粒子直径小、光热转换率高、渗透性和保留(EPR)强,已经成为PTT的主要介体。由金纳米团簇(Au25)与上转换纳米颗粒(UCNPs @ MS)形成的多功能平台具有出色的PTT和PDT效应,808 nm激光照射下的抑瘤效果被大幅度增强。此外, DNA官能化的UCNP @ SiO2-Au NPs在PTT和温度触发的药物递送有巨大潜力。但存在静脉内给药传统治疗法减少纳米材料积累、肿瘤部位光热效应减弱、副作用、不可降解排出体外等问题。为了克服这些局限性,开发用于靶向治疗恶性肿瘤的新型光热材料,特别是降低肿瘤复发非常重要。
近期,同济大学、中国科学院长春应用化学研究所与美国麻萨诸塞州总医院和哈佛医学院通过DNA的静电络合上转换镧系元素-Au纳米颗粒共同合作开发了一种新型近红外光响应可注射的DNA-无机混合水凝胶(DNA-UCNP-Au水凝胶)。与原始的无机纳米材料相比,DNA-UCNP-Au水凝胶具有较低的细胞毒性,在相同的近红外辐射下升温速度更快。可通过注射局部治疗将水凝胶精确地负载在肿瘤部位周围,消除肿瘤组织,并且有效抑制肿瘤复发,同时对正常组织无副作用。结果以“Injectable and NIR‐Responsive DNA–Inorganic Hybrid Hydrogels with Outstanding Photothermal Therapy”为题发表在期刊《Advanced Materials》上。
与以往将稀土掺杂荧光上转换纳米颗粒作为荧光探针用于检测不同,本实验合成的稀土-金杂化纳米材料(UCNP-AuNPs)中,上转换纳米颗粒作为可接收近红外光的能量中转站来使用,通过荧光共振能量转移,将能量传递给表面的各向同性超小金纳米粒子,后者通过表面等离子体共振将能量以热能的形式释放出去。UCNP-Au NPs的紫外吸收峰正好匹配UCNP经808nm激光照射后在可见光区的发射峰,二者之间通过非辐射的方式实现能量传递,从而高效的将光能转换为热能。
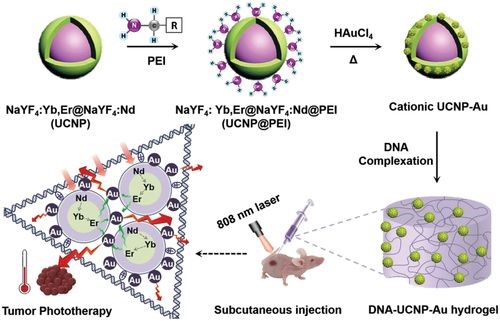
图1 注射用DNA-无机杂化水凝胶(DNA-UCNP-Au)的示意图
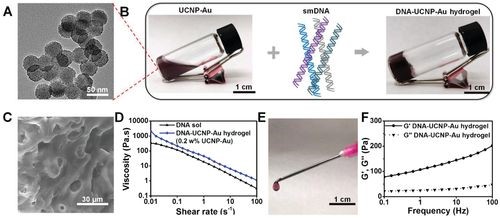
先以溶剂热法制备了掺有Yb3+和Er3+的单分散NaYF4纳米颗粒,然后以其为核心与NaYF4:Nd形成杂化物。NaYF4:Yb,Er @ NaYF4:Nd(UCNP)通过配体交换过程进一步转化为亲水性UCNP-PEI,聚醚酰亚胺(PEI)作为表面涂层剂代替原始的油酸配体。接下来,通过PEI和HAuCl4之间的氧化还原反应形成UCNP-Au NP。UCNP-Au NPs是分层混合结构,Au NPs(≈1-2nm)桥接在UCNPs的表面,直径为32.4±1.6 nm(图2A)。最后,将鲑鱼精子DNA(smDNA,2000 bp)与阳离子UCNP-Au NPs进行静电络合制备DNA-UCNP-Au水凝胶(图2B)。
图2 注射用DNA–UCNP–Au水凝胶的制备和表征。(A)UCNP-Au NP的透射电子显微镜(TEM);(B)通过鲑鱼DNA和UCNP-Au NP的静电复合形成DNA-UCNP-Au水凝胶;(C)DNA–UCNP–Au水凝胶的扫描电子显微镜(SEM)图像;(D)DNA–UCNP–Au水凝胶的粘度测量;(E)水凝胶具有可注射性;(F)DNA–UCNP–Au水凝胶的频率模量
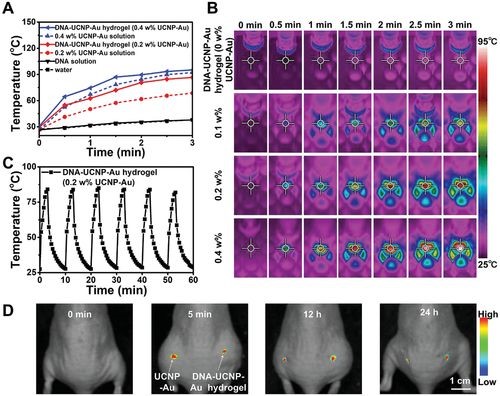
随后,研究人员又对DNA–UCNP–Au水凝胶的光热性能进行了研究。UV-vis和荧光测量结果表明, NIR激光照射下UCNP和Au NP之间的距离很小,可能发生有效的荧光共振能量转移。由于各向同性的Au NPs的等离子体共振吸收,UCNP-Au NPs在540 nm处有很强的吸收。当使用808 nm激光时,它刺激了540 nm处UCNP的发射,在这种情况下,作为能量受体的超小金纳米粒子进一步引起表面等离子体共振以实现光热转换。作者制备了具有不同浓度的无机纳米粒子的DNA–UCNP–Au水凝胶(图3A)。在808 nm激光照射下,较高的UCNP-Au NP浓度(例如0.4 w%)可缩短升温时间、提高加热温度(高于90°C)。相反,相同浓度Au NP的光热效率相比低得多(图3A),热图像对比度也可确认这一现象(图3B)。DNA–UCNP–Au水凝胶的光热转换效率(η)为42.7%,远高于UCNP–Au NP(32.4%)。这些结果表明,通过与DNA的络合形成的UCNP-Au NPs网络对光热效应起着重要的作用。皮下注射12小时后,原始UCNP-Au NP的排放量下降。但是DNA–UCNP–Au水凝胶治疗组在24小时后仍保持稳定发射(图3D),这表明DNA分子在稳定纳米颗粒方面起着重要作用。
图3 注射用DNA–UCNP‐Au水凝胶的光热效应。(A)在近红外光照射下,DNA–UCNP–Au水凝胶的温度演化;(B)在不同时间段内暴露于808 nm激光下不同浓度的无机纳米颗粒的DNA–UCNP–Au水凝胶的热图像;(C)DNA–UCNP‐Au水凝胶(0.2 w%UCNP‐Au)中的近红外响应和可逆加热/冷却曲线;(D)在不同时间点用DNA-UCNP-Au水凝胶处理的小鼠体内荧光成像
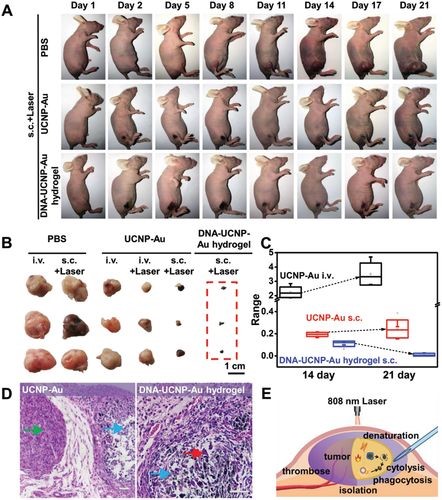
为了研究体内的PTT作用,研究人员使用了在后腿区域右后方带有T24肿瘤的雌性BALB/c裸鼠。将三个样品,DNA–UCNP‐Au水凝胶(0.2 w%UCNP‐Au),0.2 w%UCNP‐Au水溶液和PBS,分别在肿瘤周围皮下注射(sc)或通过尾静脉注射(iv)静脉。NIR照射后,观察小鼠的肿瘤变化21天(图4A)。该激光在体内对正常组织的热损伤方面副作用较小,且样品无毒,在所有组中均未观察到明显的体重变化。DNA-UCNP-Au水凝胶治疗组的肿瘤生长得到了显著抑制,并且未见复发(图4B,C)。在此过程中,经水凝胶处理的小鼠肿瘤的局部温度在NIR照射后3分钟内升高到62.2°C。该温度足够高以通过瞬时融化癌细胞膜并使蛋白质变性从而消除癌细胞。同时,高温使肿瘤的血管痉挛,血管内血栓形成,进一步引起细胞凋亡和肿瘤组织坏死。炎症因子巨噬细胞随后清除癌细胞(图4D)。此外,苏木精和曙红染色结果表明,DNA–UCNP–Au水凝胶及其PTT治疗对正常组织和器官没有副作用。而UCNP-Au纳米粒子由于无凝胶网络使之分布受限,导致热量分布不均匀,所以尽管温度达到56.8°C,但仍无法消除肿瘤并复发。
图4 基于可注射DNA–UCNP‐Au水凝胶的体内光热疗法。(A)在经过3分钟照射后21天内,用DNA–UCNP‐Au水凝胶,UCNP‐Au和PBS样品处理的雌性BALB / c裸鼠携带T24肿瘤的照片;(B)不同治疗后分离出的肿瘤的照片;(C)用UCNP-Au(iv),UCNP-Au(sc)和DNA-UCNP-Au水凝胶(sc)处理的孤立肿瘤的体积范围统计;(D)肿瘤玻片的苏木精和曙红染色图像;(E)基于可注射DNA–UCNP–Au水凝胶的光热疗法的拟议机制
该研究的意义在于,通过材料的组合应用,开拓了稀土掺杂荧光上转换纳米材料的光热性能;相较于静脉应用以及局部注射光热纳米材料,局部注射光热凝胶抗肿瘤效果更为确切,为其他光热材料的研发提供了启示作用。
全文链接:https://doi.org/10.1002/adma.202004460